إنّ الانتشار المتزايد للسمنة سيثقل كاهل نظام الرعاية الصحية أكثر مما كان متوقعًا في الماضي، لأنه اتضح أن السمنة تمثل عامل خطر رئيس يؤدي إلى الإصابة بالسرطان؛ حيث ترتفع بشدة لدى مَن يعانون من السمنة احتمالات الإصابة بأحد أنواع سرطان البنكرياس، المعروف باسم السرطان الغُدِّي القنوي البنكرياسي...
بقلم: ميليك كنان أركان
في حالة السمنة والإصابة بسرطان البنكرياس، تؤدي التفاعلات الكثيرة بين الخلايا الدهنية والبيئة المكروية الالتهابية المحيطة بالورم إلى تَراجُع القدرة على التكهن بتطور المرض، وأيضًا تَراجُع فعالية العلاج الكيميائي إلى مستوى أقل من المتوسط.
إنّ الانتشار المتزايد للسمنة سيثقل كاهل نظام الرعاية الصحية أكثر مما كان متوقعًا في الماضي، لأنه اتضح أن السمنة تمثل عامل خطر رئيس يؤدي إلى الإصابة بالسرطان؛ حيث ترتفع بشدة لدى مَن يعانون من السمنة احتمالات الإصابة بأحد أنواع سرطان البنكرياس، المعروف باسم السرطان الغُدِّي القنوي البنكرياسي، الذي يحتل المرتبة الرابعة بين أكثر مسبِّبات الوفاة المرتبطة بالسرطان شيوعًا. وتُعَدّ البيئة المكروية الالتهابية سمة مميزة لمرض السرطان، بيد أنه لا تتوافر معلومات كثيرة عن كيفية إسهام التغيرات في الأنسجة الضامة المحيطة (السدى) في بدء تكوُّن وتطور الأورام في حالة السمنة. وفي تقرير نشرته دورية "كانسر ديسكَفَري" Cancer Discovery، كشف إنسيو وآخرون2 عن بحثهم في كيفية إسهام الخلايا الدهنية في البيئة المكروية المحيطة بالخلايا السرطانية في بدء تكون الأورام وتطوُّرها لدى الفئران والبشر.
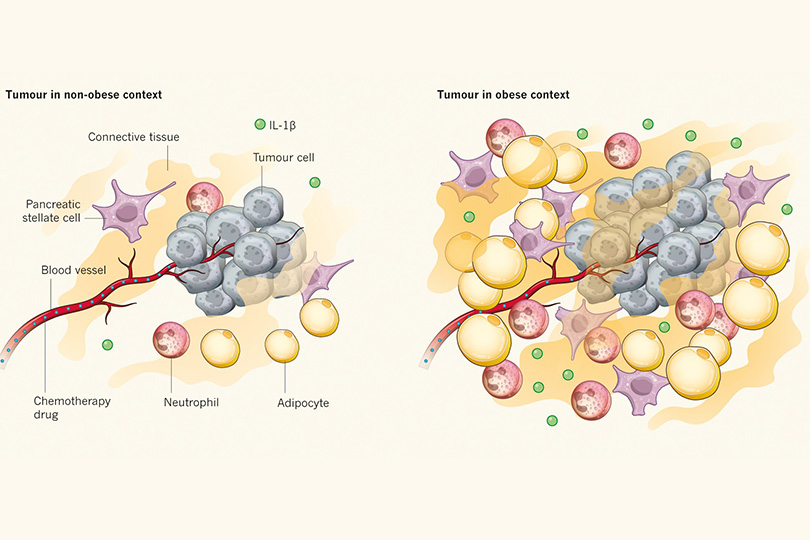
ينطوي تكوُّن الورم في البنكرياس على إحداث تشويه هيكلي مذهل للأنسجة، يرجع إلى اختلال الخلايا العُنيبية، التي تحتوي على إنزيمات هاضمة، وتسلل الخلايا المناعية للنسيج، واستجابة تليُّفية قوية (ما يعرف أيضًا باسم التليف: تكوُّن نسيج ضام زائد، أو بروتين الكولاجين حول الورم)، إضافة إلى ارتفاع مستوى ترسُّب مواد النسيج خارج الخلية عن المستوى المعتاد. وعادةً ما ترتبط الآفات السرطانية في الأشخاص الذين يعانون من السمنة بزيادة محتويات الخلايا الدهنية (الخلايا الشحمية)، مقارنةً بالأورام في حالة المرضى الذين لا يعانون من السمنة؛ ومع ذلك لا يزال الغموض يكتنف وظيفة هذه الخلايا الدهنية في سرطان البنكرياس.
يوضّح إنسيو وزملاؤه أنه في حالة الفئران، تقوم الخلايا الشحمية مع الخلايا المناعية والخلايا النجمية البنكرياسية بإرسال إشارة من خلال بروتين إنترلوكين 1 بيتا (IL-1β)، ومستقبِل الأنجيوتنسين AT1؛ لدفع الخلايا المناعية المعروفة باسم "الخلايا المتعادلة" إلى الهجرة إلى البيئة المكروية للورم، الأمر الذي يزيد من الالتهاب والتليف في البيئة المكروية لسرطان البنكرياس بطريقة تؤدي إلى ضعف الاستجابة للعلاج الكيميائي وتَراجُع القدرة على التكهن بتطور المرض. وفي الفئران البدينة، اتضح احتواء البيئة المكروية للورم على خلايا شحمية زائدة من حيث الحجم والعدد، ويرجع ذلك جزئيًّا إلى مهاجمة الأورام للأنسجة الشحمية البيضاء المجاورة. ولاحظ الباحثون زيادة التليف في مناطق الورم، التي تزداد فيها الخلايا الشحمية، أو الواقعة بالقرب من الأنسجة الشحمية. وتشير هذه النتائج إلى أن التليف سمة مميزة للأنسجة الشحمية في الفئران البدينة المصابة بسرطان البنكرياس، وأن تراكم بروتين الكولاجين للنسيج خارج الخلية، الذي يُعَدّ أحد مكونات التليف، في محيط الخلايا الدهنية هو أحد السمات المميزة للسمنة. كما توصل إنسيو وزملاؤه إلى أن تسلل الخلايا الشحمية إلى البيئة المكروية للورم يرتبط بسوء التكهن بتطور المرض، وضعف نتائج العلاج لدى المرضى.
افترض الباحثون أن تراكم الخلايا الشحمية المرتبط بالسمنة لدى الأشخاص المصابين بسرطان البنكرياس يزيد من التليف، ويعزّز من تطور الورم، ويعوق وصول العلاج الكيميائي وفعاليته. وعندما فحصوا النسبة المئوية للأوعية الدموية التي تعرضت للتروية في منطقة معينة من الأورام لدى الفئران؛ وجدوا أنها قد انخفضت بشكل كبير في الفئران البدينة.
ولتحديد ما إذا كانت عرقلة التروية من خلال الأوعية الدموية هي المسؤولة عن ضعف توصيل عوامل العلاج الكيميائين أم لا، قام الباحثون بقياس امتصاص العلاج الكيميائي "فلورويوراسيل-5" لدى الفئران، وتَبَيَّن أن السمنة قد خَفَّضت من امتصاص الورم للدواء بشكل ملحوظ، مقارنة بالامتصاص في الحيوانات غير البدينة، ومن ثم يقلل من فعالية العلاج الكيميائي.
الخلايا الدهنية تعيد تشكيل البيئة المكروية حول الأورام. تحدث تروية الأورام عن طريق الأوعية الدموية، وهو ما يسمح لعقاقير العلاج الكيميائي بالدخول. ويفيد إنسيو وآخرون2 بأنه في حالة السمنة يكون الوصول إلى أورام البنكرياس مقيدًا، بسبب ضعف تروية الأوعية الدموية للورم، مما يؤدي إلى ضعف استجابة الخلايا السرطانية لعقاقير العلاج الكيميائي. وفي حالة السمنة أيضًا تزداد الخلايا النجمية البنكرياسية، والخلايا المناعية، مثل الخلايا المتعادلة، وجزيئات بروتين إنترلوكين 1 بيتا المرسِلة للإشارات، وكذلك الخلايا الدهنية الأكبر (الخلايا الشحمية). وتمارس البيئة المكروية الخلوية الأكثر كثافة في حالة السمنة المزيد من التوتر الميكانيكي على النسيج، وقد تعوق تروية الأوعية الدموية. وينشأ هذا التوتر الميكانيكي بسبب تداخل الإشارات بين الخلايا الشحمية، والخلايا المتعادلة، والخلايا النجمية البنكرياسية، والعناصر الأخرى في البيئة المكروية للنسيج. ويؤدي هذا التداخل إلى زيادة الخلايا الالتهابية، مثل الخلايا المتعادلة، والنسيج الضامّ الليفي الزائد بجوار الورم.
ومن المعتقَد أن التليف المزمن له دور كبير في تعزيز نمو الورم، وفي إضعاف وصول العقاقير. ومع ذلك تشير الدراسات السابقة إلى أن تثبيط التليف المزمن، إمّا عن طريق المركبات المثبّطة3، أو الطفرات الجينية3,4، قد نتجت عنه زيادة في التثبيط المناعي، وتسارع نمو الورم، وانخفاض فرص البقاء على قيد الحياة، مما يشير إلى أن سدى الورم قد يحدّ من نمو الورم.
وعلى النقيض، يشير إنسيو وزملاؤه إلى أن تثبيط الممر الرئيس المحفِّز للتليف لإشارات مستقبِل الأنجيوتنسين AT1 في الفئران أسهَم في تثبيط تطور الورم. ويقترح الباحثون أن الانتقال إلى نسيج الخلايا المتعادلة المرتبطة بالورم وإنتاج بروتين إنترلوكين 1 بيتا يمثلان محركَين رئيسَين في تنظيم نمو الورم في هذا السياق، رغم أن التغيرات في التروية الوعائية ـ نتيجة انخفاض ضغط الدم ـ لعبت دورًا محدودًا أيضًا. وحين قام الباحثون باستنزاف الخلايا المتعادلة، أو إيقاف نشاط بروتين إنترلوكين 1 بيتا باستخدام العلاج بالأجسام المضادة؛ أُعيد تشكيل البيئة المكروية المثبطة للمناعة، وانخفض تطور سرطان البنكرياس. وحين يتم استهداف إشارات مستقبِل الأنجيوتنسين AT1 في الفئران، قد تتأثر عمليات أخرى في مسار إشارات هذا المستقبِل، من بينها تحول الخلايا الظهارية إلى خلايا اللُّحمة المتوسطة، أو تمايز الخلايا الشحمية. ومن الممكن أن تكون هذه العمليات مسؤولة عن انخفاض تطور الورم المصاحِب للسمنة.
ورغم أن الباحثين ربطوا بين الاستجابة التليُّفية، وحجم الورم، إلا أنه من الصعب تقرير ما الذي يحدث أولًا: الاستجابة التليُّفية، أم نمو الورم، لأن الحدّ من تطور الورم سيؤدي في النهاية إلى انخفاض تسلل الخلايا المناعية إلى البيئة المكروية للورم، وانخفاض نسبة التليف. وفي الحالتين، فإن نتائج هذه الدراسة وغيرها من الدراسات3,4 تعزِّز من الحاجة إلى إجراء تقييم إضافي للإسهام الوظيفي للتليف في بدء سرطان البنكرياس وتطوره، لاسيما لدى المرضى المصابين بالسمنة.
ويزداد في الوقت الراهن الاعتقاد بأن التغيرات الخلوية الناتجة عن القوى الميكانيكية لها دور في الإصابة بأمراض عديدة5، فالاستتباب في التوازن بين القوى الداخلية والخارجية المؤثرة على الخلايا (حالة التوتر البدني المعروف باسم الاستتباب التوتري) يمكن أن ينظم موت الخلايا المبرمج، وتكاثر الخلايا، والتصاق الخلايا وهجرتها؛ في حين قد يؤدي عدم التنظيم إلى زيادة احتمال التعرض للإصابة بالسرطان. وإضافة إلى ذلك، فإن الإشارات البدنية القادمة من الضغط المبذول بواسطة مكونات النسيج الصلب للبيئة المكروية للورم يمكن أن تضغط الأوعية الدموية؛ مسبِّبةً تراجعًا في تروية الورم.
لقد أثبت إنسيو وزملاؤه أن العلاج بواسطة عقار "لوسارتان" ـ وهو أحد حاصرات مُستقبِل الأنجيوتنسين AT1 ـ يمكن أن يقلل من التوتر الميكانيكي على الخلايا، ويقلل من نمو الورم في الفئران المصابة بسرطان البنكرياس. وثمة حاجة إلى إجراء المزيد من الأبحاث؛ لدراسة نوع التحول في نسخ الحمض النووي الناتج عن الاستتباب التوتري في الوسط الخلوي الكثيف للبيئة المكروية للورم في حالة السمنة. ربما يوفر تثبيط القوى الميكانيكية المؤثرة على الخلايا في سرطان البنكرياس دلالات أخرى للعلاج الإكلينيكي المستقبلي. وقد يبدو جَعْل النسيج خارج الخلية للورم طبيعيًّا، عن طريق تقليل تَيَبُّس النسيج أكثر فعالية وأمانًا من محاولة التخلص من المكونات السَّدَوِيّة مباشرة.
وتمثل العلاقة بين الخلايا الدهنية، وتنظيم الخلايا الجذعية قضية أساسية أخرى. وتستجيب الخلايا الشحمية البيضاء الناضجة ـ مستودعات الدهون التي تتحكم في أيض الطاقة ـ للإشارات الغذائية والهرمونية، من خلال إفراز بروتينات باعثة للإشارات. وتشير الدراسات إلى أن الدهن الشحمي الأبيض له دور في إعادة بناء الأنسجة وتنظيم الخلايا الجذعية، مما يضع الخلايا الدهنية في قلب عديد من جوانب تطور السرطان. وتسهم الخلايا الجذعية المتعلقة باللُّحمة المتوسطة أو الخلايا الجذعية السَّدَوِيّة بشكل كبير في توليد الخلايا الشحمية. كما يمثل التوتر الميكانيكي أحد محفزات توسع بعض مجموعات الخلايا الجذعية.
سيكون من المثير للاهتمام تحديد منشأ الخلايا الشحمية في البنكرياس، ومصيرها، والنمط الظاهري لها (ما إذا كانت الخلايا تكوِّن دهونًا بيضاء، أم بُنِّيَّة، وكذلك نوع المركب الذي تفرزه). ومن بين الموضوعات الأخرى الجديرة بالبحث: دراسة إسهام الإشارات المستمدة من الخلايا الشحمية، التي تُطَوِّع وربما تستقطب تمايز الخلايا المناعية، ووظيفة اختراق الخلايا الشحمية خلال تكون الورم، ودور قصور أيض الطاقة في حالات السمنة.
إن الدراسة التي أجراها إنسيو وزملاؤه تقدِّم تفسيرًا خلويًّا وجزيئيًّا منطقيًّا؛ لزيادة تفاعل الخلايا الشحمية مع خلايا البيئة المكروية للورم المحفزة للالتهاب، والمحفزة للتليف، التي تعمل بدورها على تسريع تطور المرض، وإعاقة العلاج، لكن يبقى السؤال: هل الاستهداف النظامي للخلايا المتعادلة، أو الخلايا النجمية البنكرياسية، أو الخلايا الشحمية المرتبطة بالورم ممكنٌ بدون التسبُّب في أضرار جانبية لوظائف المضيف؟ قد تشكِّل هذه الأضرار تحديًا كبيرًا في نقل هذه النتائج مباشرة بنجاح، من السياق النظري إلى التجارب الإكلينيكية. ولن يتسنى لنا معرفة ما إذا كان استهداف بروتين إنترلوكين 1 بيتا، أو الخلايا المتعادلة قد يوفر فرصًا للتدخل العلاجي الناجح، أم لا، سوى بمرور الزمن. وفي غضون ذلك يظل أفضل نهج وقائي هو تناول طعام صحي، وممارسة التمرينات الرياضية.



اضف تعليق